癌症作为全球第二大死因,其治疗长期面临毒性大、靶向性差等关键科学难题。五环三萜类化合物熊果酸(Ursolic Acid, UA)作为植物源性天然产物,能够特异性调控多条肿瘤相关信号通路,实现多重抗肿瘤效应,但其水溶性差、生物利用度低等缺陷严重制约临床应用。
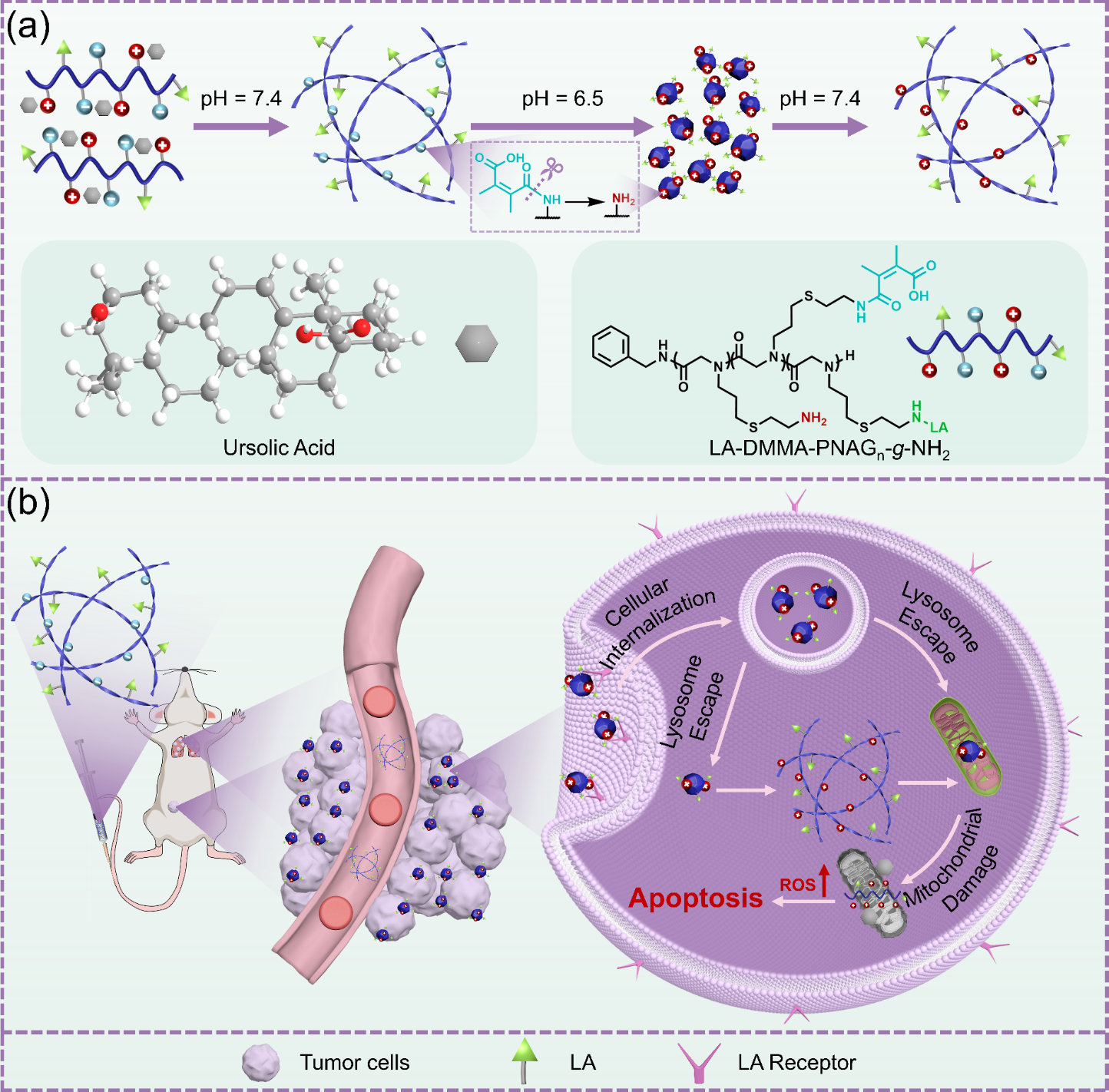
图1.酸响应性纳米纤维的制备及抗肿瘤机理。
天然分子伴侣通过精确调控蛋白质折叠与组装维持细胞稳态,这一特性为克服UA递送难题提供了新思路。受分子伴侣蛋白动态调控机制的启发,化学学院陈学思院士和孙静教授研究团队创新性地提出仿生递送策略(图1),设计开发了仿分子伴侣功能的生物活性聚类肽组装辅助因子,通过模拟生物大分子的精准组装过程,成功构建了具有pH响应特性的纳米纤维载药体系(图2),显著提升了UA的抗肿瘤疗效,为肿瘤靶向治疗提供了创新性解决方案。
本研究通过分子设计在系统中引入酸响应基团和靶向配体,实现了UA在肿瘤微环境(TME)中的精准递送。研究表明,该纳米系统具有独特的结构转换特性:在中性条件下保持稳定的螺旋纳米纤维形态,而在酸性TME中则可逆转变为病毒样纳米颗粒,这种形态转变显著增强了药物在肿瘤组织中的渗透能力。
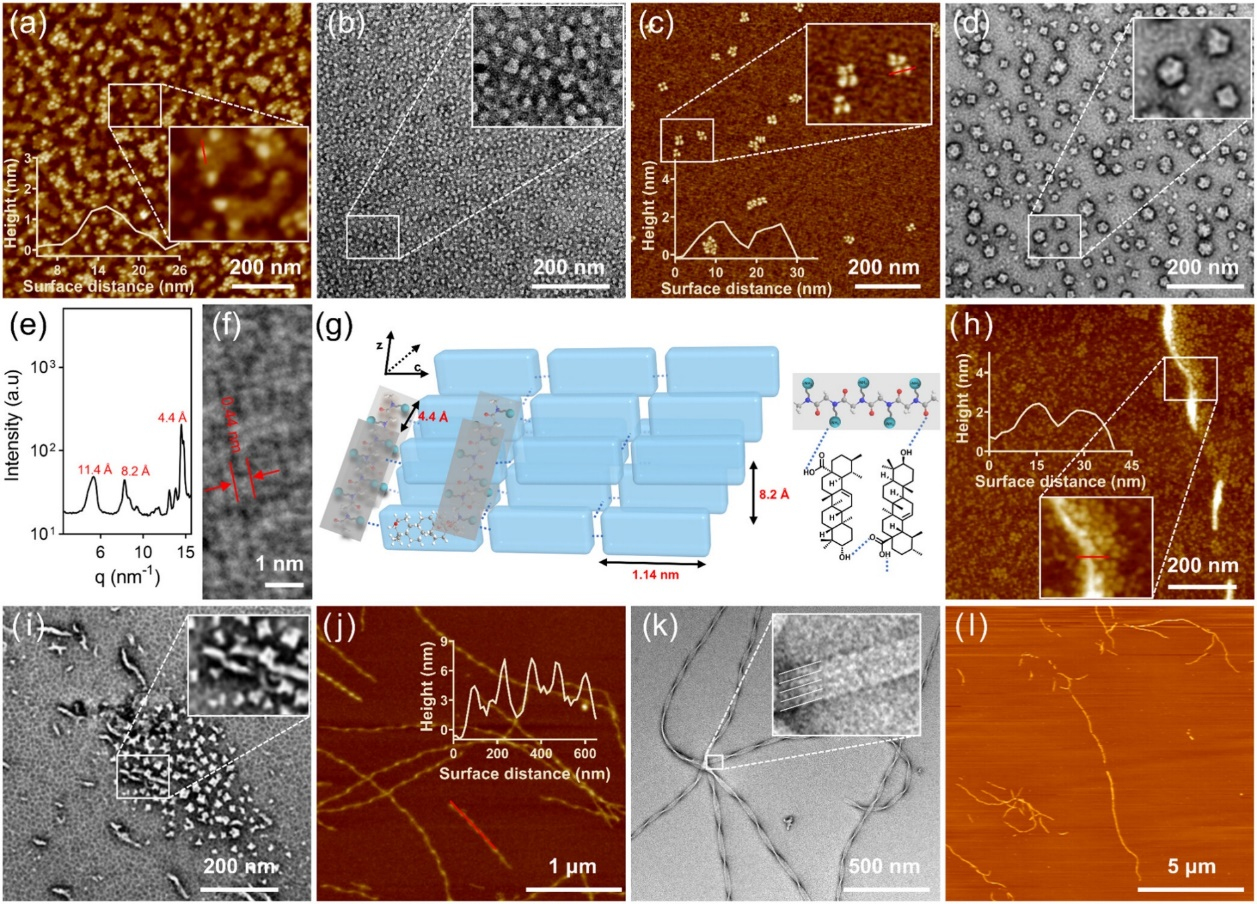
图2.纳米纤维的形成过程。
机制研究发现,肿瘤细胞内化后,病毒样纳米颗粒能够有效实现溶酶体逃逸并在线粒体周围特异性富集。在活性氧(ROS)作用下,硫醚键发生氧化断裂,触发UA及活性聚类肽的协同释放,进而通过诱导线粒体损伤特异性激活凋亡通路。值得注意的是,部分纳米颗粒在细胞质中性环境中可重新组装为纤维结构,这种动态重构行为不仅延长了药物在细胞内的滞留时间,更强化了线粒体靶向效应和治疗效果(图3)。该递送系统展现出显著的协同抗肿瘤效应,其治疗效果显著优于单一UA或聚类肽组分。动物实验进一步证实,该体系在抑制肿瘤生长和转移方面具有显著优势。
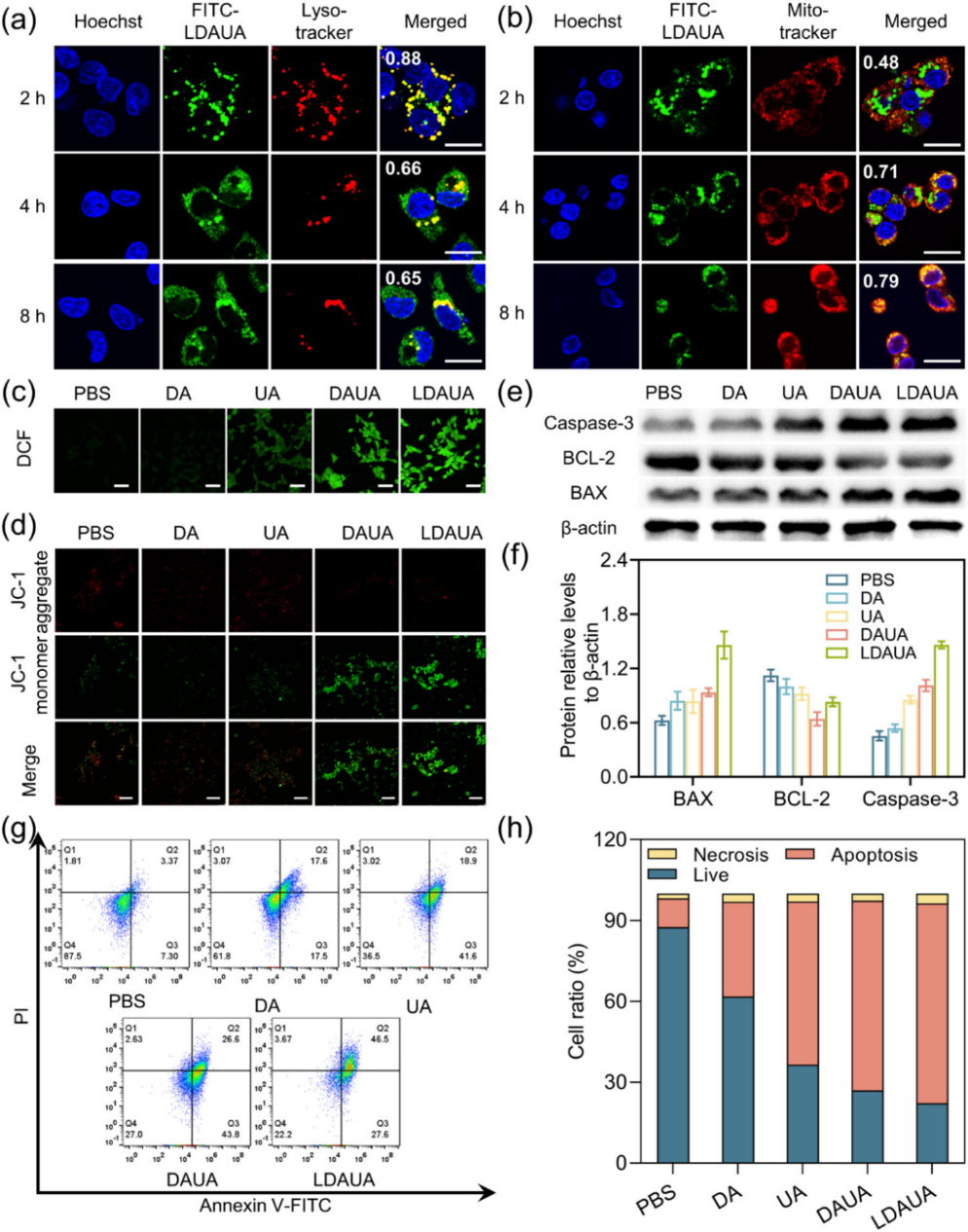
图3. TME响应性纳米药物的抗肿瘤机理。
本研究提出的"天然活性分子-聚类肽"精准共组装策略,为天然产物的纳米医学应用开辟了新途径。该研究不仅解决了UA临床应用的关键技术瓶颈,其设计理念更为开发其他天然抗肿瘤药物的递送系统提供了重要参考,具有显著的临床应用价值和转化潜力。
该工作以“Bioactive Assembly Cofactor-Assisted Ursolic Acid Helix for Enhanced Anticancer Efficacyvia In SituVirus-like Transition”为题发表在《Journal of the American Chemical Society》上,DOI: 10.1021/jacs.5c01214。文章第一作者是化学学院博士后林敏,通讯作者为化学学院孙静教授。该研究得到国家自然科学基金委的支持。该研究一经发表,便获得英国皇家化学会主办的《化学世界》(Chemistry World)关注,对此项研究进行了专访。