细胞的氧化还原稳态是维持正常生命活动的基础,细胞内氧化还原的失衡,通常是活性氧(ROS)水平增加导致。超氧化物歧化酶(SOD)作为抵御ROS损伤的第一道防线,可以直接清除超氧阴离子(O2·-),降低ROS水平。最常见的SOD类型包括CuZnSOD和MnSOD。对于CuZnSOD,催化位点中Cu2+与四个组氨酸残基中的咪唑基配位,对于MnSOD,锰离子与3个组氨酸残基中的咪唑基和1个天冬氨酸残基中的羧基进行配位。CuZnSOD催化过程伴随着Cu2+与其中一个咪唑基之间的配位键的断裂/重连。然而,该催化中心存在严重的空间阻碍,催化反应受到较稳定的Cu2+/咪唑基配位键难断裂的限制,降低了催化反应的效率以及催化中心稳定性。受MnSOD的启发,羧基同样可以参与催化位点的结构组成,如果引入组氨酸分子,就会在铜离子/咪唑基配位的基础上引入铜离子/氨基配位和铜离子/羧基配位,有可能实现对CuZnSOD催化位点的优化。通过密度泛函计算对多种催化中心进行比较。利用氨基及羧基对咪唑基进行替换,降低了空间位阻,同时较稳定的铜/羧基配位键的引入有助于进一步降低结构的总能量,从而增强催化中心的稳定性。此外,相较于铜/咪唑基和铜/羧基配位键,铜/氨基配位键键能更小,更容易发生断裂,有助于催化反应的引发。最终得到结构稳定性和反应活性均优于天然酶结构的催化中心,即Cu2+同时和2个咪唑基、1个羧基和1个氨基进行配位的结构。基于计算结果,通过对铜离子、锌离子、组氨酸混合溶液的pH值、溶剂组成和温度的精准调控,成功制备了铜/锌/组氨酸(CuZnHis)超分子组装体。CuZnHis的类SOD催化活性达到37900 Unit/mg,至少是天然SOD的5.4倍。CuZnHis可以通过高效清除O2·-,降低ROS水平,潜在用于氧化应激相关疾病的治疗。
该研究成果以“Cu/Zn/Histidine Supramolecular Assemblies with Optimized Cu Catalytic Sites as an Alternative of Superoxide Dismutase”为题发表在Nat. Commun.上(Nat. Commun. 2025, 16, 10075)。吉林大学化学学院博士研究生晋皓为第一作者,吉林大学刘树威、张皓为通讯作者。
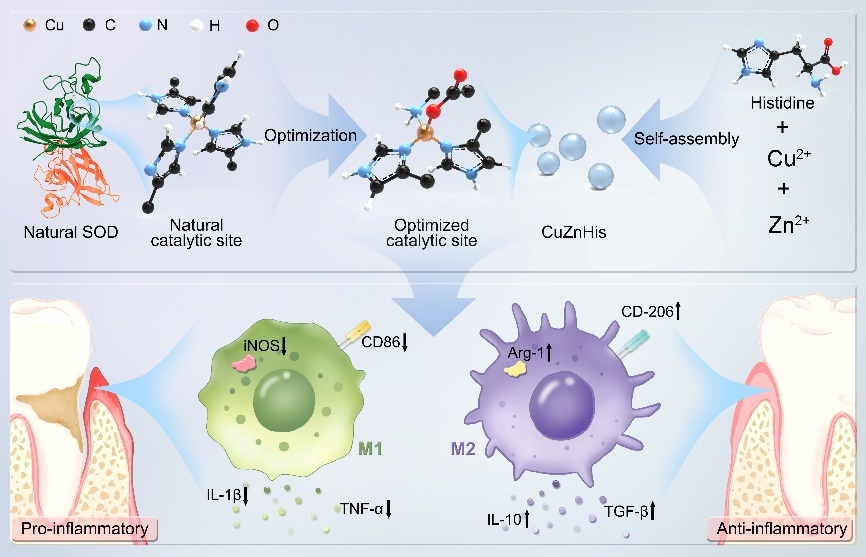
图1 优化铜催化位点制备的CuZnHis组装体及其抗炎机制。
论文链接:https://doi.org/10.1038/s41467-025-65074-7