在全球公共卫生领域,抗生素耐药性问题日益严峻,尤其是被称为“超级细菌”的多重耐药金黄色葡萄球菌(MRSA),已成为临床治疗的重大挑战,严重威胁人类生命健康。根据世界卫生组织(WHO)的报告,抗生素耐药性每年导致全球数百万人死亡或患病。日益上升的耐药比率与新型抗生素研发进展缓慢相互交织,进一步加剧了这一危机的严重性。因此,开发针对多重耐药金黄色葡萄球菌的新型治疗策略已显得尤为迫切。
面对这一难题,吉林大学陈学思院士和孙静教授研究团队设计了一种简洁、高效的策略,通过集成多种协同抗菌组分,成功开发出一种新型智能纳米囊泡抗菌平台-DAClLy,有效借助组分间的协同增强效应,不仅在细菌感染部位实现精准富集与智能释药,更通过多重机制协同抗菌,高效清除耐药菌和生物膜,大幅提升杀菌效率。这一策略有效克服了传统单机制给药的局限性,其简洁高效的设计,为临床耐药菌感染治疗提供了新的治疗解决方案,也为应对全球健康威胁提供了一条具有转化前景的可行路径。
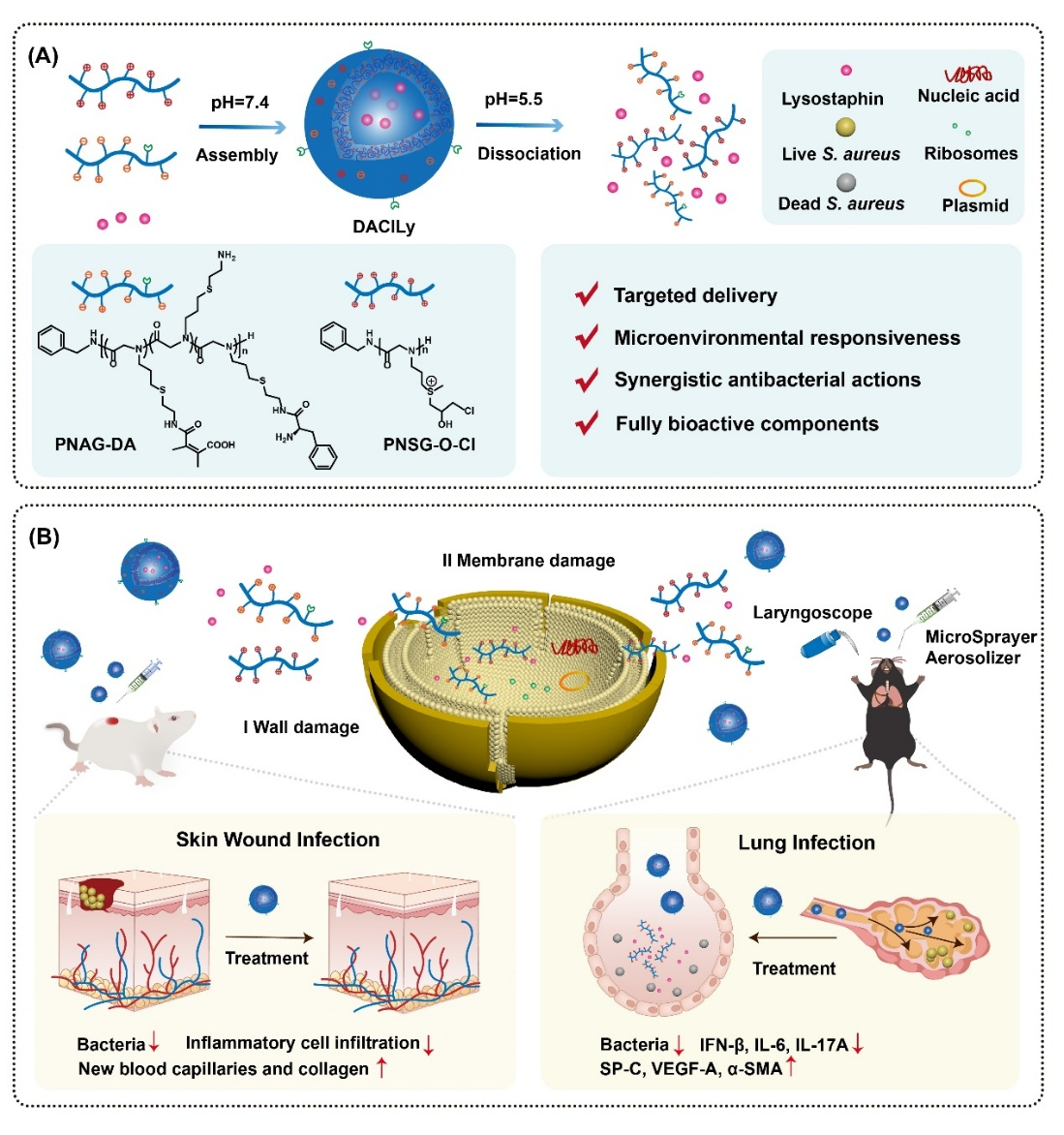
图1.DAClLy纳米囊泡的构建及其抗菌机制。
研究团队基于静电作用,将两种带相反电荷的聚类肽材料——含硫鎓聚类肽(PNSG-O-Cl)和2,3-二甲基马来酸酐修饰的含氨基聚类肽(PNAG-DA)——组装成纳米囊泡结构(图1)。进一步,将可特异性切割金黄色葡萄球菌细胞壁的溶葡萄球菌酶(Lysostaphin, Ly)封装于囊泡内部。此外,通过在囊泡表面修饰D-氨基酸,赋予其靶向识别能力,使其能精准富集于细菌感染部位。在健康的人体组织中,DAClLy纳米囊泡保持结构稳定,从而最大限度地降低对正常组织的毒副作用。一旦抵达细菌感染区域,该处因细菌代谢所致的酸性微环境会触发囊泡的响应性释放机制,迅速释放出包载的溶葡萄球菌酶及带正电的抗菌聚类肽。溶葡萄球菌酶可以高效降解细菌细胞壁的肽聚糖结构,增强聚类肽对细胞膜的接触,进而通过破坏膜结构实现高效杀灭细菌。这种级联协同作用产生了1+1>2的强效抗菌效果,使耐药菌难以逃脱。
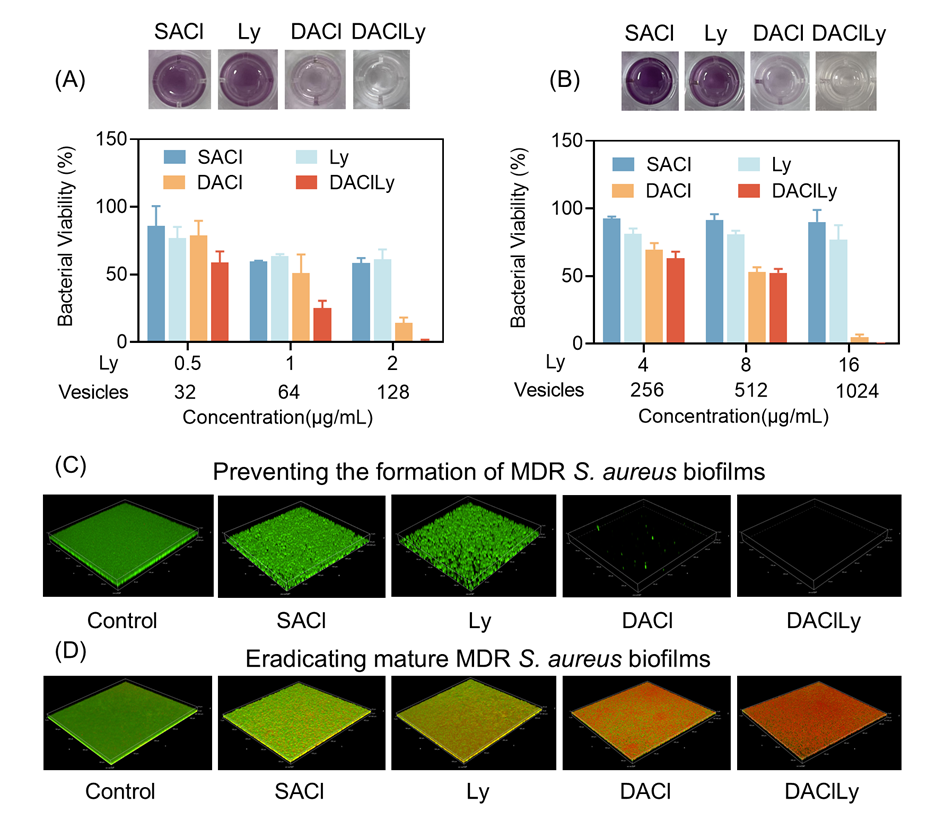
图2.对抗多重耐药金黄色葡萄球菌生物膜。
实验结果表明,DAClLy纳米囊泡在体外对多种耐药金黄色葡萄球菌均表现出显著杀菌活性,且在酸性条件下其杀菌效率远高于单一组分或其他对照组。此外,这种材料不仅能预防生物膜形成,还对已形成的成熟生物膜具有强大清除能力,杀菌率超过99%,克服了传统疗法对生物膜渗透性差、效果欠佳的局限。(图2)。
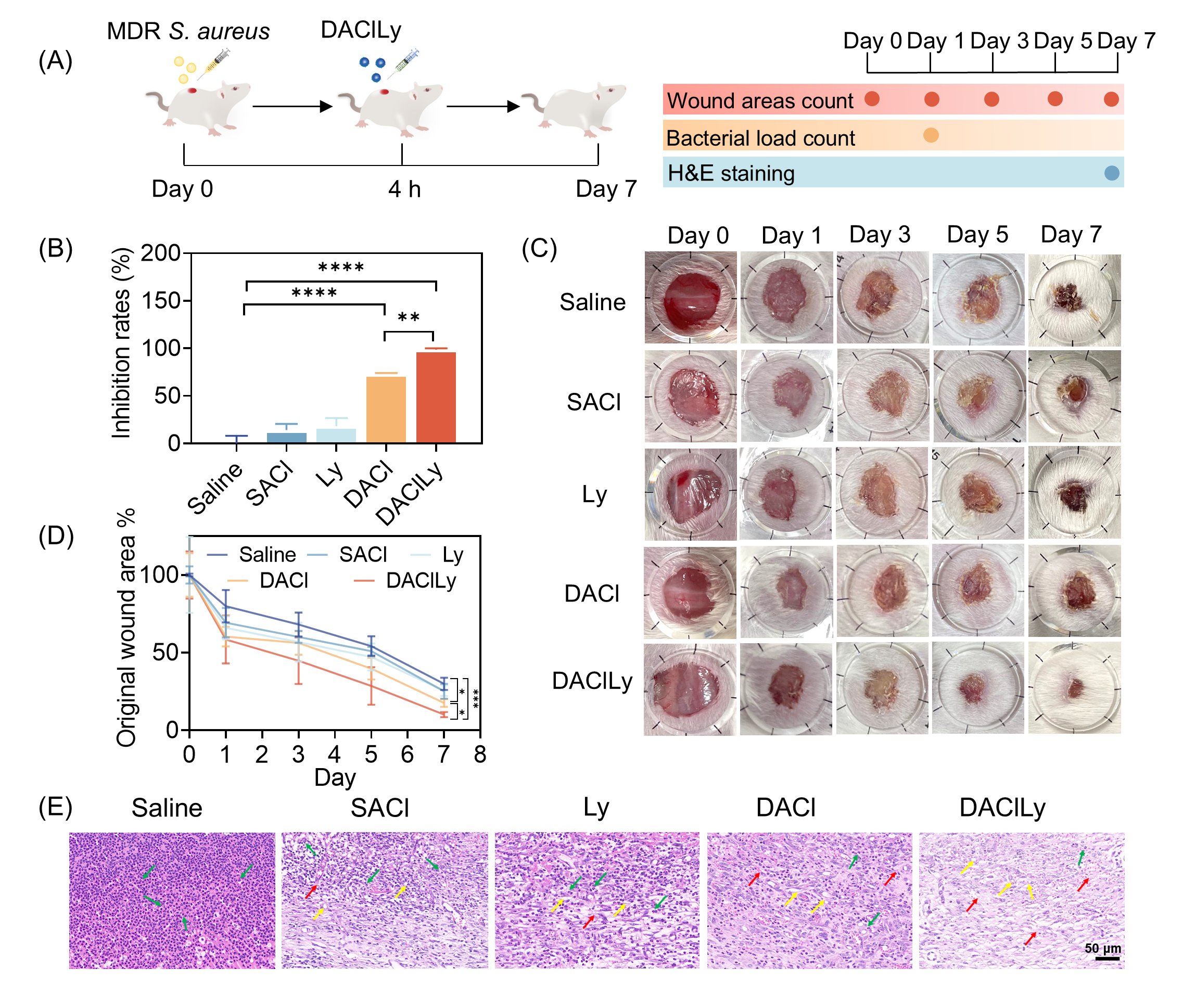
图3.DAClLy纳米囊泡在小鼠皮肤伤口感染中的抗菌活性。
在体内实验中,DAClLy纳米囊泡的疗效进一步得到验证。在小鼠皮肤伤口感染模型中,经DAClLy治疗的小鼠伤口细菌负载量显著降低,伤口愈合速度明显加快,炎症反应减轻(图3)。在肺部感染模型中,凭借其纳米级尺寸和表面电负性,DAClLy展现出优异的肺部黏液屏障穿透能力,能有效将药物递送至深部肺组织。治疗结果证实,这种材料可高效清除肺部耐药菌,显著降低炎症因子水平,并促进肺组织修复相关蛋白的表达,加速肺部损伤的修复进程(图4)。
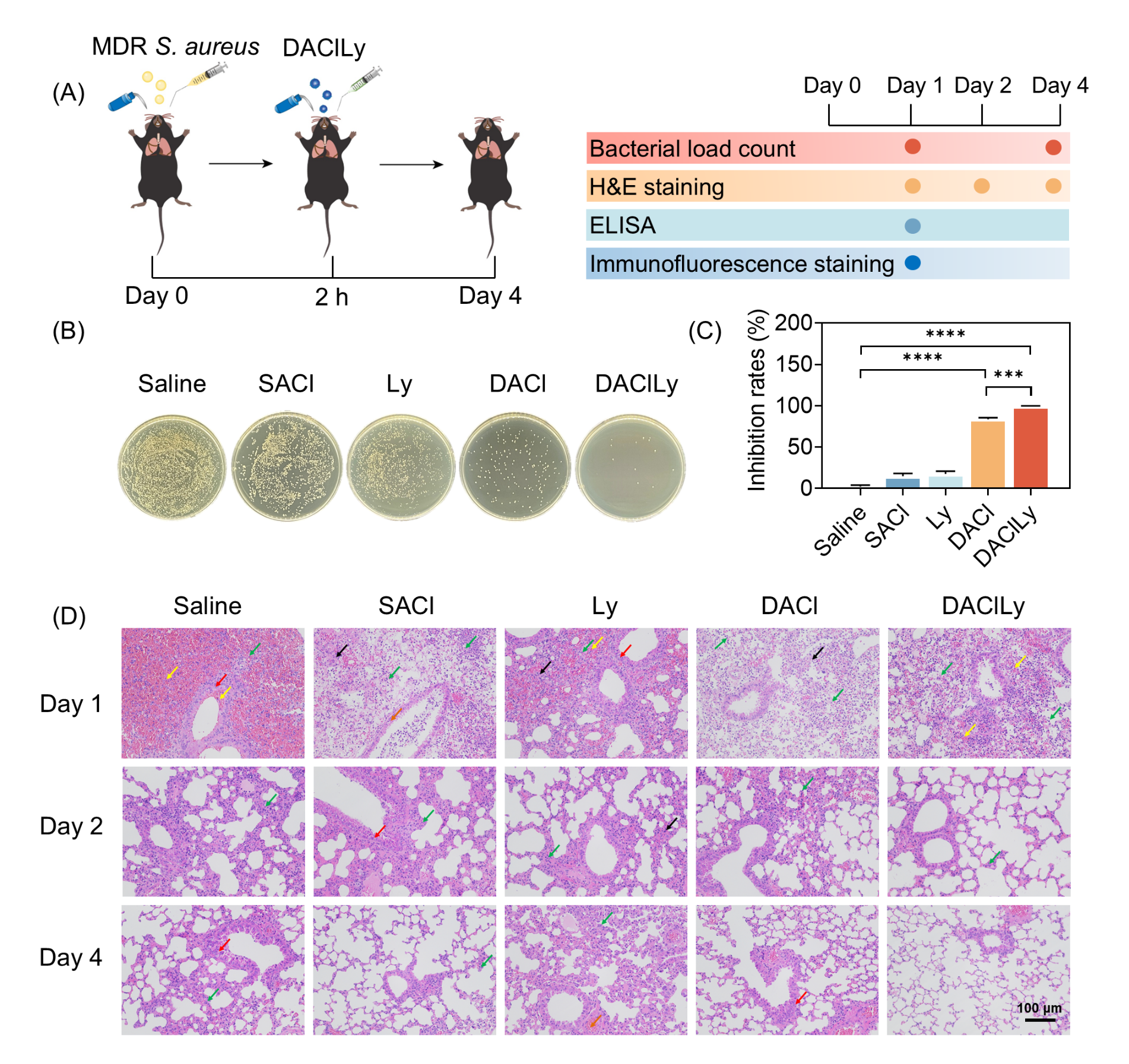
图4.DAClLy纳米囊泡在小鼠肺部感染中的抗菌活性。
该工作以“Targeted Cascade Therapy with Multifunctional Nanovesicles Engineered from Synergistic Antibacterial Agents for Precision Treatment of Multidrug-Resistant Infections and Biofilms”为题发表在《Advanced Materials》上,DOI: 10.1002/adma.202511037。文章第一作者是吉林大学化学学院博士研究生公一宇。该研究得到国家重点研发计划(2022YFC2603900)和国家自然科学基金(52273294)的支持。
论文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202511037