近年来,酶级联反应作为新型的癌症治疗策略得到了广泛关注。与传统疗法相比,酶级联反应展现出较高的特异性、可控性和高效性,显著提高了治疗效果并减少了副作用。然而,天然酶在临床应用中面临诸多挑战,如稳定性差、失活以及肿瘤选择性不足等。开发高效的酶级联纳米反应器是当下亟需解决的问题。复合凝聚是液-液相分离的一种形式,在生命起源中扮演了独特角色,为设计功能性纳米反应器提供了新思路。然而传统聚电解质形成的复合凝聚物通过宏观相分离复合而成,其结构形成较为复杂,尺寸通常较大,且分散度高、稳定性较差。
针对这些难题,陈学思院士-孙静教授课题组成功构建了一种基于复合凝聚作用的肿瘤微环境响应多功能纳米反应器(HGS-PCVs),实现了药物在肿瘤部位的靶向递送以及高效的癌症治疗效果,同时成功激活了免疫原性细胞死亡,促进了树突状细胞的成熟,刺激了适应性T细胞反应,有效抑制了远端肿瘤的生长。该工作以题为“Coacervation-Driven Semipermeable Nanoreactors for Enzymatic Cascade-Mediated Cancer Combination Therapy with Enhanced Efficacy”的文章发表在Advanced Materials杂志上。
在本工作中,首先通过在PCVs表面修饰乳糖酸,赋予其靶向递送能力,同时负载疏水性抗癌药物索拉非尼(SRF)和功能性蛋白(血红蛋白(Hb)和葡萄糖氧化酶(GOx))。在肿瘤微环境条件下,SRF加速释放,有效降低了PCVs膜的通透性,葡萄糖选择性进入其内部,触发酶级联反应,并产生有毒的羟基自由基,同时进一步降低体系的pH,促进SRF释放。体外实验表明,SRF与GOx/Hb的联合治疗促进细胞内产生大量的活性氧,使谷胱甘肽过氧化物酶4失活,破坏线粒体的功能,导致脂质过氧化物积累,共同诱导细胞的凋亡和铁死亡,促进肿瘤细胞的死亡。小鼠体内实验结果表明,这种联合治疗策略具有高效的抗肿瘤活性,并能引起细胞的免疫原性死亡,有效促进树突状细胞的成熟,提高毒性T细胞和辅助T细胞的比例,进一步抑制远端肿瘤的生长。该方法为肿瘤联合治疗提供了一条新的有效途径,具有良好的应用前景。
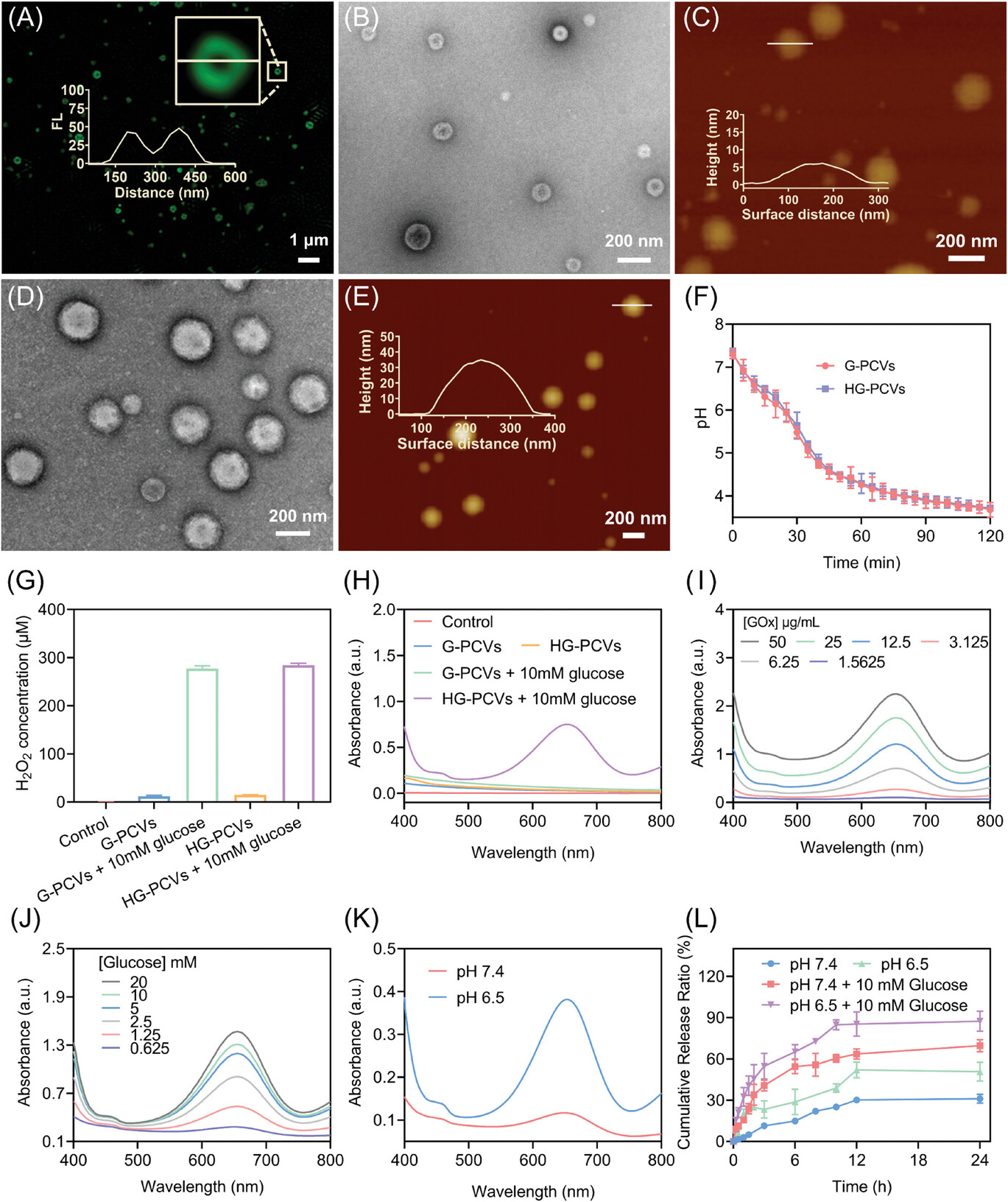
图1.多功能纳米反应器的制备以及pH响应性测试。
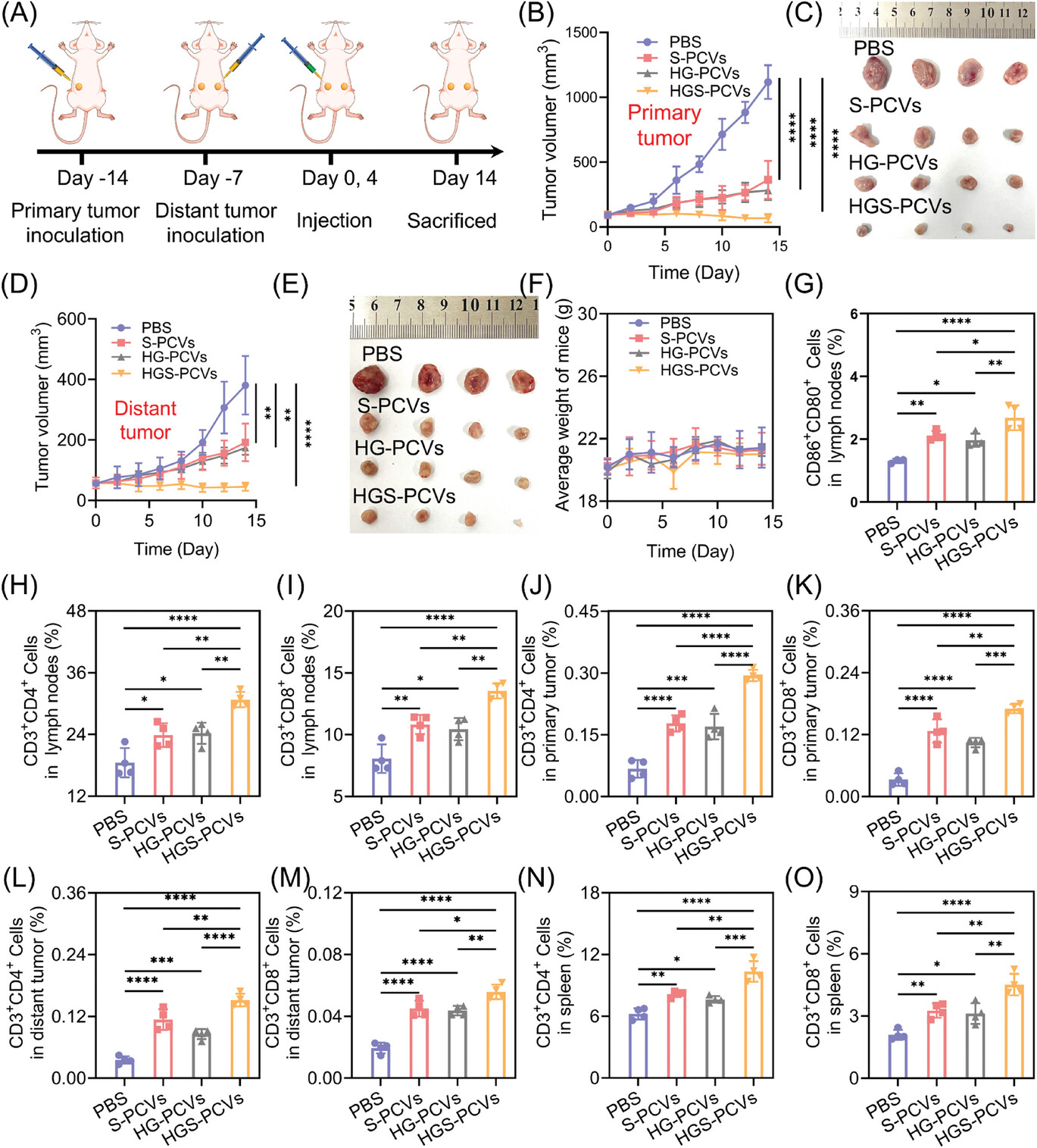
图2.体内免疫测试。